Preparazione al regolamento MDR
Medline sta lavorando duramente in vista del nuovo Regolamento Europeo sui Dispositivi Medici (MDR). Il nostro obiettivo è infatti disporre dei certificati MDR relativi a tutti i prodotti presenti nel nostro portfolio entro il 2023, un anno prima di quanto previsto.
Cosa si intende per MDR?
Il Regolamento MDR sostituisce la ancora vigente Direttiva Europea sui Dispositivi Medici (MDD, Medical Device Directive), e si rivolgerà a ciascun produttore di dispositivi medici che commercializza i propri articoli all’interno del mercato europeo. Il regolamento è entrato in vigore il 25 Maggio 2017, e dunque ci troviamo adesso nel cosiddetto periodo di transizione, in cui entrambe le legislazioni possono essere applicate. A partire dalla data del 27 Maggio 2024, però, soltanto i dispositivi dotati di certificazione conforme al regolamento MDR saranno destinati alla vendita.
Quali sono le principali differenze fra la direttiva MDD ed il regolamento MDR?
Il regolamento MDR si fonda sulla direttiva MDD ed introduce nuove disposizioni inerenti gli articoli medici destinati alla vendita nel mercato europeo, con l’obiettivo primario di incrementare la sicurezza e l’efficienza del settore riservato ai dispositivi medici. Se confrontato con la direttiva MDD, il regolamento MDR:
- Aumenta gli obblighi di indagine ed ispezione dal punto di vista clinico e controlla eventuali rischi al fine di garantire la sicurezza dei pazienti
- Intensifica l’attività di sorveglianza e la gestione dell’intero ciclo di vita dei Dispositivi Medici
- Migliora la trasparenza e la tracciabilità
- Limita le situazioni di ambiguità grazie a classificazioni e definizioni estremamente chiare e precise.
Il Regolamento MDR presenta inoltre requisiti più restrittivi per la designazione degli organismi notificati, con un innalzamento dei controlli e della sorveglianza ad opera delle autorità nazionali competenti e della Commissione Europea.
Cosa comporta l’attuazione del regolamento MDR per Medline e per l’intero settore dei dispositivi medici?
L’MDR interesserà ogni dispositivo medico commercializzato in Europa, sia realizzato nell’ambito europeo che importato da stati non facenti parte della comunità europea. Questi dispositivi dovranno perciò ottenere nuove certificazioni CE che soddisfino tale regolamento, entro e non oltre il 27 Maggio 2024. Il percorso di Medline verso il regolamento MDR prosegue tuttavia a passo spedito.
Quali sono le scadenze più importanti, e qual è lo stato dell’arte di Medline?
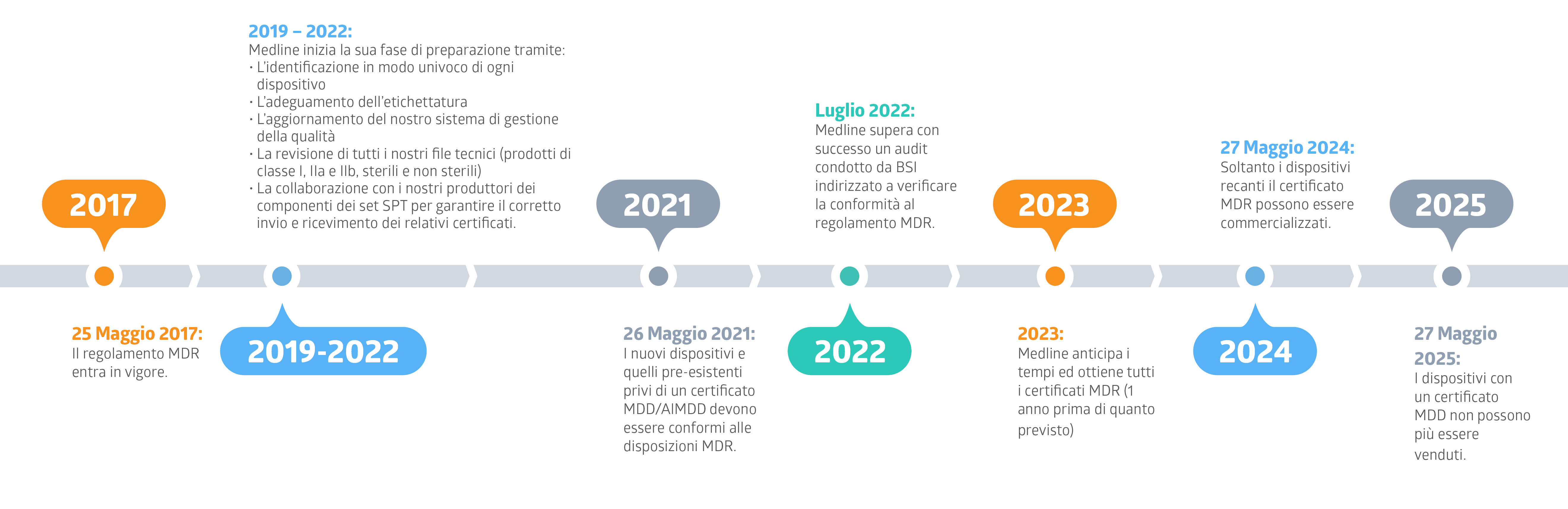

Dove si possono reperire gli ultimi aggiornamenti sull’avanzamento della preparazione di Medline nei confronti del regolamento MDR?
Medline Continua la sua Fase Preparatoria verso il regolamento MDR grazie al Superamento con Successo di un Audit condotto da BSI (Pubblicato in data 27/07/2022)
Preparazione al Nuovo Regolamento Europeo sui Dispositivi Medici (Medical Devices Regulation, MDR) (Pubblicato in data 17/12/2019)

